Dicembre: periodo di feste, regali, di grandi pranzi e di altissimi livelli di colesterolo! Ebbene si, FIMMG Formazione Area Scientifica non va in vacanza neanche in questi giorni e anzi vi propone uno Speciale della rubrica “Sono tutti uguali” ad argomento “Statine”.
Buona lettura e Buona digestione

Esistono diverse molecole in grado di intervenire sul metabolismo dei lipidi, fra questi le statine, o inibitori di HMG CoA reduttasi (idrossimetilglutaril-CoA-reduttasi), rappresentano una fra le più importanti armi a nostra disposizione nell’ambito delle dislipidemie. L’abbassamento lipidico tramite questi farmaci ha dimostrato di apportare grande beneficio sia per i disturbi primari che secondari ed esplica la sua azione clinica tramite la riduzione del rischio cardiovascolare, la stabilizzazione della placca, il ripristino delle disfunzioni endoteliali, la riduzione della trombogenicità e la regressione dell’aterosclerosi (che tuttavia avviene solo in una minima parte dei pazienti).
MECCANISMO D’AZIONE
Le statine sono inibitori competitivi dell’enzima HMG CoA reduttasi. La loro azione è mediata dall’occupazione del sito legante il substrato, ne consegue che il substrato stesso non avrà quindi possibilità di legarsi all’enzima e tantomeno di accedere al sito catalitico.
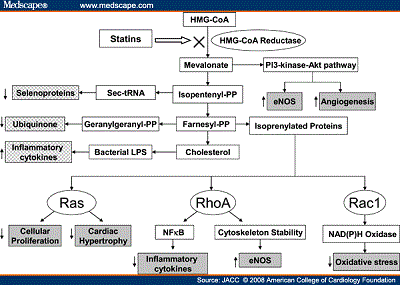
Questa riduzione di sintesi del colesterolo intraepatico porta ad un aumento dei recettori delle LDL con conseguente maggior turnover delle LDL stesse e cattura epatica implementata. Inoltre le statine riducono i livelli di VLDL tramite effetto mediato dalla secrezione epatica di apo B, molecola in grado di diminuire la percentuale di HMG che si riattiva durante il trattamento farmaceutico. Aspetto negativo è la scarsa interazione delle statine con il colesterolo HDL, i cui valori con l’utilizzo del farmaco risultano aumentati solamente di circa 5% complessivamente. Anche il metabolismo dei trigliceridi è influenzato dalle statine, tanto che si stima una loro riduzione del 20-40% una volta iniziata la terapia.
Per informazioni più dettagliate si rimanda al video che segue
CLICCA QUI PER VEDERE IL VIDEO
GENERAZIONI
I: Lovastatina, Simvastatina, Pravastatina
II: Fluvastatina
III: Atorvastatina, Rosuvastatina
PRESCRIZIONE
In Italia la prescrizione di statine tramite il Sistema Sanitario Nazionale è mediato dalla nota 13, la quale rappresenta spesso un ostacolo alla dispensazione corretta del farmaco viste le grandi variabili da tenere in considerazione.
Testo completo della NOTA 13 AL LINK
A questo proposito si consiglia un’ applicazione per Smartphone e Iphone molto utile tramite la quale è possibile stimare il rischio cardiovascolare attraverso la compilazione di una breve serie di dati anamnestici e laboratoristici, e sarà inoltre possibile valutare se il paziente ha diritto o meno alla prescrizione a carico del SSN ed eventualmente quali statine possono essere prescritte.
APPLICAZIONE
Una volta scaricata l’App comparirà l’avviso che segue:

Sarà quindi necessario, prima di poter utilizzarla iscriversi e registrarsi a www.opendoctor.it cliccando il LINK.
NB: L’App da sola non basta per fornire una corretta terapia, le informazioni che seguiranno rappresentano gli strumenti base per poter scegliere con razionalità quale molecola è più adatta per il nostro paziente.
EFFICACIA
GRAFICO 1
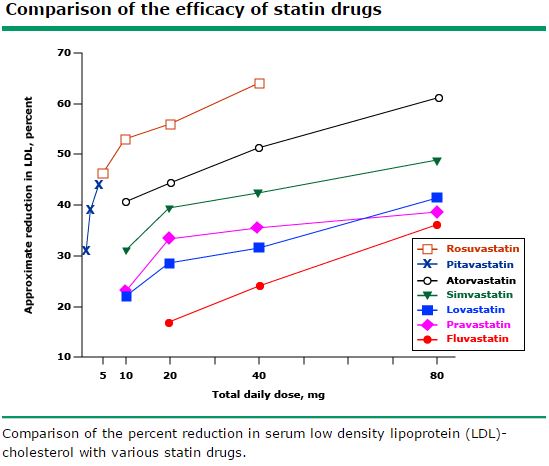
LDL
Come si può notare dal grafico soprariportato le molecole con maggior efficacia sulla riduzione del colesterolo LDL sono (ordine decrescente):
1)Rosuvastatina
2)Atorvastatina
3)Simvastatina/Lovastatina
4)Pravastatina
5)Fluvastatina
HDL
Come già anticipato le statine non hanno effetto importante sulle HDL, tuttavia se si dovesse stilare una “classifica” delle molecole che hanno dimostrato maggiore efficacia, quelle riportate di seguito sarebbero le prime 3 (in ordine decrescente):
1)Rosuvastatina
2)Simvastatina
3)Atorvastatina
In diversi studi la Rosuvastatina si è dimostrata in grado di aumentare l’HDL fino al 10%. L’effetto variabile delle statine su questo tipo di colesterolo sembrerebbe essere legato al loro effetto sul microRNA33 epatico il quale sembrerebbe “upregolare” la sintesi di HDL.
TRIGLICERIDI
Atorvastatina e Rosuvastatina sono le molecole con maggior capacità di ridurre i trigliceridi (dal 14% al 33%) . L’effetto di questi farmaci è però dose dipendente. Solo a titolo esemplificativo in un pool di pazienti con ipertrigliceridemia (600 mg/dL) la somministrazione di Atorvastatina alla dose di 5, 20 o 80 mg ha prodotto una riduzione dei trigliceridi rispettivamente del 27%, 32% e del 46 %.
Questi dati valgono davvero per tutta la popolazione?
In realtà bisogna fare una precisazione. Esiste una certa variabilità di risposta individuale sia per quanto riguarda l’efficacia che per gli effetti avversi. Questa sembra essere legata alle differenze genetiche implicate nel metabolismo. Ad esempio il CYP2D6 ha un ruolo importante nei pazienti trattati con Simvastatina visto che è in grado di influenzare pesantemente il tasso di tollerabilità ed efficacia del farmaco. Altro parametro importante è il possibile polimorfismo dell’ HMG CoA reduttasi. Dati sperimentali hanno dimostrato come pazienti asiatici possano avere una risposta maggiore già a basse dosi di statine rispetto ai caucasici, in particolar modo per quanto riguarda la Rosuvastatina.
SOMMINISTRAZIONE
Di seguito si riportano alcune tabelle i cui valori verranno interpretati e trattati con il proseguo dell’articolo.
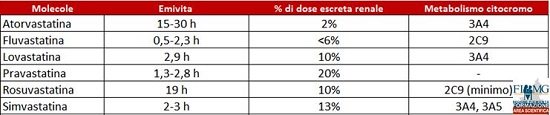
TAB 1
TAB 2
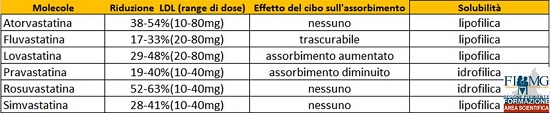
La gran parte della sintesi di colesterolo avviene durante la notte. Per questo motivo è tipicamente raccomandata la somministrazione delle statine con minore emivita la sera prima di andare a dormire. In supporto a questa raccomandazione, diversi studi hanno riscontrato una maggiore riduzione del colesterolo totale e LDL quando la Simvastatina ( t ½ relativamente breve) veniva somministrata la sera invece che al mattino. Conclusioni diverse sono state raggiunte con l’Atorvastatina ad esempio (t ½ relativamente lunga), la quale non ha evidenziato differenze nella somministrazione al mattino o alla sera.
EFFETTI AVVERSI
Reazioni averse avvengono meno frequentemente con le statine rispetto ad altre classi di agenti ipolipemizzanti. Da segnalare sicuramente la possibilità di disfunzione epatica; tuttavia il rischio stimato di una elevazione degli enzimi del fagato risulta davvero basso (0,5% di raddoppiare o triplicare il valore di transaminasi, 1% di avere un valore più di 3 volte maggiore alla norma). Al contrario disturbi a livello dell’apparato muscolare (incidenza di 1,5-5%) risultano la prima complicanza da tenere in considerazione. Secondo alcuni studi le statine più lipofiliche (Simvastatina, Atorvastatina, Lovastatina e Fluvastatina) potrebbero essere associate ad un maggior numero di eventi avversi rispetto a quelle più idrofiliche come la Pravastatina e la Rosuvastatina. In questo contesto tuttavia la Fluvastatina sembrerebbe avere un profilo di sicurezza simile a quello dimostrato dalle statine idrofiliche per quanto riguarda l’apparato muscolare.
NB: differenze di eventi avversi nella popolazione sono sicuramente da ricondurre anche ad eterogeneità dei pathways di eliminazione.
Cosa fare quando il paziente non tollera la statina?
Nonostante le statine siano quindi complessivamente ben tollerate nei trial clinici, esiste una certa discordanza con l’esperienza clinica dove una non irrilevante percentuale di casi richiede la sospensione del farmaco a causa di riferita mialgia o altri sintomi muscolari. Meno frequentemente la causa della sospensione è dovuta ad un rialzo degli enzimi epatici.
SCHEMA PER LA GESTIONE DI EVENTI AVVERSI MUSCOLARI statino-indotti secondo UptoDate “management of statin myopathy”:
1)In caso di mialgia sospendere la statina, valutare livelli di CK, ed aspettare la risoluzione dei sintomi ed il ritorno delle CK al livello di base (verificato prima dell’inizio della terapia). Se CK > 6000 U/L in paziente idratato (o >2000 U/L in paziente severamente disidratato), la probabilità di insufficienza renale acuta con mionecrosi e mioglobinuria è tangibile. In questi casi indirizzare il paziente in Pronto Soccorso.
2)Verificare interazioni possibili con le statine (vedi sezione “INTERAZIONI” a seguire).
Se presenti sostituire la statina in uso con Pravastatina, Fluvastatina o Rosuvastatina o eventualmente altro farmaco non di questa classe.
Se non presenti interazioni valutare eventuale ipotiroidismo o carenza di vitamina D. Questo perché si è visto come il trattamento con statine durante ipotiroidismo o carenza di vitamina D rappresenterebbe un fattore di rischio concreto per lo sviluppo di mialgia e rabdomiolisi. In questi casi è bene correggere eventuali patologie sottostanti e poi riprovare ad assumere la statina sospesa. Se l’effetto avverso ricompare, cambiare statina vertendo su Pravastatina e Fluvastatina.
3)Se il paziente ha effetti avversi anche con Pravastatina e Fluvastatina, mantenere uno di questi due farmaci tentando la somministrazione a giorni alterni.
SCHEMA PER LA GESTIONE DI EVENTI AVVERSI EPATICI:
L’aumento di ALT deve essere di almeno 3 volte il livello superiore di normalità, confermato alla ripetizione del test, per giustificare uno dei seguenti provvedimenti terapeutici:
- Sostituire l’attuale statina in uso con la Pravastatina
- Ridurre la dose della statina in uso
- Somministrazione della statina a giorni alterni
INTERAZIONE TRA FARMACI
Il rischio di interazioni è molto legato al fatto che diverse statine come la Simvastatina e l’Atorvastatina sono metabolizzate a livello del citocromo P4503A4 (vedi TAB 1). Pravastatina, Fluvastatina, Rosuvastatina sono da preferire se concomita terapia con un forte inibitore di CYP3A4.
CURIOSITA’: Il polmpelmo è un inibitore naturale di questo citocromo, tuttavia non è necessaria la completa astensione da questo cibo, infatti fino a mezzo pompelmo al giorno è cosiderata una dose sicura con buona approssimazione.
Inibitori ed induttori CYP3A4 ed altri citocromi disponibili sul sito della FDA (Food and Drug Administration) al LINK
Ecco alcuni accorgimenti da tenere in considerazione:
1)La Rosuvastatina nonostante non sia metabolizzata significativamente dal CYP3A4, i suoi livelli ematici sono aumentati dagli inibitori di proteasi come lopinavir/ritonavir e atazanavir/ritonavir.
2)La Pravastatina è la statina di scelta in pazienti sotto trattamento con ciclosporina.
3)Pravastatina e in misura minore Fluvastatina sono le molecole di scelta nei pazienti in trattamento con fibrati come Gembfibrozil. Tuttavia come regola generale il Fenofibrato è da preferire in pazienti che richiedono terapia combinata con statine.
4)In pazienti che assumono Amlodipina, le dosi di Simvastatina non dovrebbe superare i 20 mg/die
NB: il Clopidogrel è attivato dal metabolismo del CYP450, tuttavia le attuali evidenze NON hanno dimostrato grossi problemi con la cosomministrazione di statine.
MONITORAGGIO
Il monitoraggio routinario della creatinin-kinasi sierica (CK) non è raccomandato in pazienti in terapia con statine in assenza di sintomi; è però utile ottenere un livello “baseline” di riferimento prima di iniziare la terapia. Discorso analogo per quanto riguarda i livelli di ALT e AST, i quali non devono essere controllati nel tempo in assenza di sospetto clinico ma è sufficiente valutare la ALT prima di iniziare il trattamento.
Non esistono invece dati certi sul metodo ottimale di monitoraggio degli effetti ipolipemizzanti della terapia con statina. UptoDate suggerisce di monitorare l’LDL ogni 6 settimane dopo l’inizio di un trattamento (o un cambio di dose) fino a quando si raggiunge il livello target di LDL. A seguire un monitoraggio ogni 6-12 mesi è ragionevole in tutti i pazienti che aderiscono anche ai cambiamenti di stile di vita.
POPOLAZIONI PARTICOLARI
Insufficienza Epatica 
Per i pazienti con insufficienza epatica cronica compensata ed alto rischio cardiovascolare i quali necessitano di statine si suggerisce la completa astinenza dall’ alcol e l’uso di Pravastatina a basse dosi. Se il livello di colesterolo LDL rimane elevato, è consigliabile una terapia combinata con una resina a scambio ionico (es. Colestiramina) al fine di sequestrare acidi biliari intestinali e raggiungere il target terapeutico di LDL desiderato. Le statine restano comunque controindicate nella patologia epatica progressiva, acuta ed in rapida evoluzione.
Insufficienza Renale 
L’insufficienza renale cronica rappresenta una sfida per la corretta selezione di statine. Atorvastatina e Fluvastatina sono le più indicate poiché non richiedono aggiustamento di dose (escrezione renale minima, come indicato in TAB 1) e sono considerati quindi i farmaci di scelta nell’ insufficienza renale, anche severa.
Gravidanza e Allattamento 
I dati riguardo al rischio legato all’assunzione di statine in gravidanza e durante l’allattamento sono dubbi, tuttavia in assenza di elementi che confermino un adeguato profilo di sicurezza è bene sospendere l’uso di questi farmaci prima del concepimento e non utilizzarli durante l’allattamento.
CURIOSITA’
Alcuni studi osservazionali hanno suggerito come la risposta immunitaria al vaccino antinfluenzale, e la sua capacità di prevenire l’influenza, potrebbero essere ridotti in pazienti anziani riceventi terapia con statine. (per approfondimenti si rimanda all’articolo “Seasonal influenza vaccination in adults” di UpToDate nella sezione “Efficacy”).
AUTORE
Daniele Angioni
Un ringraziamento speciale alla Dott.ssa F. D’Agostino per la gentile concessione della letteratura proveniente da UpToDate
Con questo articolo si conclude il primo anno di FIMMG Formazione Area Scientifica Piemonte. Un anno che ha portato inaspettatamente questa sezione del sito a collezionare migliaia di visualizzazioni; l’articolo “Morso e punture di insetti: gestione, cura e prevenzione” ha raggiunto 15000 persone sulla pagina Facebook e addirittura 5000 letture effettive, facendoci entrare nella top 3 degli articoli più letti di sempre dalla creazione del sito, superati solo dal calcolatore di compenso e dell’articolo “Sostituzioni di medicina generale” del 2012! Per questo motivo io ed il coordinamento di FIMMG Formazione Piemonte vi rivolgiamo un grande GRAZIE con la speranza che il prossimo anno sia altrettanto pieno di sorprese e soddisfazioni “scientifiche”, continuate a seguirci
Buon Natale e Buone Feste
Ci vediamo nel 2016!

Immagine di Alessandro Alberati
BIBLIOGRAFIA
Michael Pignone et al “Treatment of lipids (including hypercholesterolemia) in primary prevention” UpToDate
Robert S. Rosenson et al “Treatment of lipids (including hypercholesterolemia) in secondary prevention” UpToDate
David M. Rind et al “Intensity of lipid lowering therapy in secondary prevention of cardiovascular disease” UpToDate
Istvan ES, Deisenhofer J. Structural mechanism for statin inhibition of HMG-CoA reductase. Science 2001; 292:1160.
Ness GC, Zhao Z, Lopez D. Inhibitors of cholesterol biosynthesis increase hepatic low-density lipoprotein receptor protein degradation. Arch Biochem Biophys 1996; 325:242.
Conde K, Vergara-Jimenez M, Krause BR, et al. Hypocholesterolemic actions of atorvastatin are associated with alterations on hepatic cholesterol metabolism and lipoprotein composition in the guinea pig. J Lipid Res 1996; 37:2372.
Arad Y, Ramakrishnan R, Ginsberg HN. Lovastatin therapy reduces low density lipoprotein apoB levels in subjects with combined hyperlipidemia by reducing the production of apoB-containing lipoproteins: implications for the pathophysiology of apoB production. J Lipid Res 1990; 31:567.
Ness GC, Chambers CM, Lopez D. Atorvastatin action involves diminished recovery of hepatic HMG-CoA reductase activity. J Lipid Res 1998; 39:75.
Larsen ML, Illingworth DR. Drug treatment of dyslipoproteinemia. Med Clin North Am 1994; 78:225.
Levy RI, Troendle AJ, Fattu JM. A quarter century of drug treatment of dyslipoproteinemia, with a focus on the new HMG-CoA reductase inhibitor fluvastatin. Circulation 1993; 87:III45.
Illingworth DR, Stein EA, Mitchel YB, et al. Comparative effects of lovastatin and niacin in primary hypercholesterolemia. A prospective trial. Arch Intern Med 1994; 154:1586.
Jones P, Kafonek S, Laurora I, Hunninghake D. Comparative dose efficacy study of atorvastatin versus simvastatin, pravastatin, lovastatin, and fluvastatin in patients with hypercholesterolemia (the CURVES study). Am J Cardiol 1998; 81:582.
Rosenson RS. Rosuvastatin: a new inhibitor of HMG-coA reductase for the treatment of dyslipidemia. Expert Rev Cardiovasc Ther 2003; 1:495.
Jones PH, Davidson MH, Stein EA, et al. Comparison of the efficacy and safety of rosuvastatin versus atorvastatin, simvastatin, and pravastatin across doses (STELLAR* Trial). Am J Cardiol 2003; 92:152.
Brown AS, Bakker-Arkema RG, Yellen L, et al. Treating patients with documented atherosclerosis to National Cholesterol Education Program-recommended low-density-lipoprotein cholesterol goals with atorvastatin, fluvastatin, lovastatin and simvastatin. J Am Coll Cardiol 1998; 32:665.
Eidelman RS, Lamas GA, Hennekens CH. The new National Cholesterol Education Program guidelines: clinical challenges for more widespread therapy of lipids to treat and prevent coronary heart disease. Arch Intern Med 2002; 162:2033.
www.fda.gov/Drugs/DrugSafety/ucm256581.htm (Accessed on March 15, 2013).
Sprecher DL, Abrams J, Allen JW, et al. Low-dose combined therapy with fluvastatin and cholestyramine in hyperlipidemic patients. Ann Intern Med 1994; 120:537.
Brown G, Albers JJ, Fisher LD, et al. Regression of coronary artery disease as a result of intensive lipid-lowering therapy in men with high levels of apolipoprotein B. N Engl J Med 1990; 323:1289.
Pan HY, DeVault AR, Swites BJ, et al. Pharmacokinetics and pharmacodynamics of pravastatin alone and with cholestyramine in hypercholesterolemia. Clin Pharmacol Ther 1990; 48:201.
Rosenson RS, Otvos JD, Hsia J. Effects of rosuvastatin and atorvastatin on LDL and HDL particle concentrations in patients with metabolic syndrome: a randomized, double-blind, controlled study. Diabetes Care 2009; 32:1087.
März W, Scharnagl H, Abletshauser C, et al. Fluvastatin lowers atherogenic dense low-density lipoproteins in postmenopausal women with the atherogenic lipoprotein phenotype. Circulation 2001; 103:1942.
Otvos JD, Shalaurova I, Freedman DS, Rosenson RS. Effects of pravastatin treatment on lipoprotein subclass profiles and particle size in the PLAC-I trial. Atherosclerosis 2002; 160:41.
Albert MA, Danielson E, Rifai N, et al. Effect of statin therapy on C-reactive protein levels: the pravastatin inflammation/CRP evaluation (PRINCE): a randomized trial and cohort study. JAMA 2001; 286:64.
Kastelein JJ, Isaacsohn JL, Ose L, et al. Comparison of effects of simvastatin versus atorvastatin on high-density lipoprotein cholesterol and apolipoprotein A-I levels. Am J Cardiol 2000; 86:221.
Niesor EJ, Schwartz GG, Perez A, et al. Statin-induced decrease in ATP-binding cassette transporter A1 expression via microRNA33 induction may counteract cholesterol efflux to high-density lipoprotein. Cardiovasc Drugs Ther 2015; 29:7.
Rosenson RS, Brewer HB Jr. New challenges for HDL-modifying therapies as a strategy to lower cardiovascular disease events in statin-treated patients. Cardiovasc Drugs Ther 2015; 29:1.
Bakker-Arkema RG, Davidson MH, Goldstein RJ, et al. Efficacy and safety of a new HMG-CoA reductase inhibitor, atorvastatin, in patients with hypertriglyceridemia. JAMA 1996; 275:128.
Davidson M, McKenney J, Stein E, et al. Comparison of one-year efficacy and safety of atorvastatin versus lovastatin in primary hypercholesterolemia. Atorvastatin Study Group I. Am J Cardiol 1997; 79:1475.
Dart A, Jerums G, Nicholson G, et al. A multicenter, double-blind, one-year study comparing safety and efficacy of atorvastatin versus simvastatin in patients with hypercholesterolemia. Am J Cardiol 1997; 80:39.
Mulder AB, van Lijf HJ, Bon MA, et al. Association of polymorphism in the cytochrome CYP2D6 and the efficacy and tolerability of simvastatin. Clin Pharmacol Ther 2001; 70:546.
Chasman DI, Posada D, Subrahmanyan L, et al. Pharmacogenetic study of statin therapy and cholesterol reduction. JAMA 2004; 291:2821.
Liao JK. Safety and efficacy of statins in Asians. Am J Cardiol 2007; 99:410.
www.astrazeneca-us.com/pi/crestor.pdf (Accessed on February 08, 2007).
Rosenson RS, Baker SK, Jacobson TA, et al. An assessment by the Statin Muscle Safety Task Force: 2014 update. J Clin Lipidol 2014; 8:S58.
Stroes ES, Thompson PD, Corsini A, et al. Statin-associated muscle symptoms: impact on statin therapy-European Atherosclerosis Society Consensus Panel Statement on Assessment, Aetiology and Management. Eur Heart J 2015; 36:1012.
Rosenson RS. Current overview of statin-induced myopathy. Am J Med 2004; 116:408.
Brewer HB Jr. Benefit-risk assessment of Rosuvastatin 10 to 40 milligrams. Am J Cardiol 2003; 92:23K.
Bruckert E, Hayem G, Dejager S, et al. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients–the PRIMO study. Cardiovasc Drugs Ther 2005; 19:403.
Kashani A, Phillips CO, Foody JM, et al. Risks associated with statin therapy: a systematic overview of randomized clinical trials. Circulation 2006; 114:2788.
Armitage J. The safety of statins in clinical practice. Lancet 2007; 370:1781.
Zhang H, Plutzky J, Skentzos S, et al. Discontinuation of statins in routine care settings: a cohort study. Ann Intern Med 2013; 158:526.
Björnsson E, Jacobsen EI, Kalaitzakis E. Hepatotoxicity associated with statins: reports of idiosyncratic liver injury post-marketing. J Hepatol 2012; 56:374.
Russo MW, Hoofnagle JH, Gu J, et al. Spectrum of statin hepatotoxicity: experience of the drug-induced liver injury network. Hepatology 2014; 60:679.
Cohen DE, Anania FA, Chalasani N, National Lipid Association Statin Safety Task Force Liver Expert Panel. An assessment of statin safety by hepatologists. Am J Cardiol 2006; 97:77C.
Downs JR, Clearfield M, Weis S, et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA 1998; 279:1615.
Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994; 344:1383.
Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002; 360:7.
Pfeffer MA, Keech A, Sacks FM, et al. Safety and tolerability of pravastatin in long-term clinical trials: prospective Pravastatin Pooling (PPP) Project. Circulation 2002; 105:2341.
Hippisley-Cox J, Coupland C. Unintended effects of statins in men and women in England and Wales: population based cohort study using the QResearch database. BMJ 2010; 340:c2197.
Smith CC, Bernstein LI, Davis RB, et al. Screening for statin-related toxicity: the yield of transaminase and creatine kinase measurements in a primary care setting. Arch Intern Med 2003; 163:688.
Charles EC, Olson KL, Sandhoff BG, et al. Evaluation of cases of severe statin-related transaminitis within a large health maintenance organization. Am J Med 2005; 118:618.
http://www.fda.gov/Drugs/DrugSafety/ucm293101.htm (Accessed on February 28, 2012).
Weismantel D, Danis P. Clinical inquiries. What laboratory monitoring is appropriate to detect adverse drug reactions in patients on cholesterol-lowering agents? J Fam Pract 2001; 50:927.
Gotto AM Jr. Safety and statin therapy: reconsidering the risks and benefits. Arch Intern Med 2003; 163:657.
Bar SL, Holmes DT, Frohlich J. Asymptomatic hypothyroidism and statin-induced myopathy. Can Fam Physician 2007; 53:428.
Lando HM, Burman KD. Two cases of statin-induced myopathy caused by induced hypothyroidism. Endocr Pract 2008; 14:726.
Vidt DG, Cressman MD, Harris S, et al. Rosuvastatin-induced arrest in progression of renal disease. Cardiology 2004; 102:52.
Sidaway JE, Davidson RG, McTaggart F, et al. Inhibitors of 3-hydroxy-3-methylglutaryl-CoA reductase reduce receptor-mediated endocytosis in opossum kidney cells. J Am Soc Nephrol 2004; 15:2258.
Alsheikh-Ali AA, Ambrose MS, Kuvin JT, Karas RH. The safety of rosuvastatin as used in common clinical practice: a postmarketing analysis. Circulation 2005; 111:3051.
Grundy SM. The issue of statin safety: where do we stand? Circulation 2005; 111:3016.
www.fda.gov/cder/drug/infopage/rosuvastatin/crestor_CP.pdf (Accessed on June 10, 2005).
McAfee AT, Ming EE, Seeger JD, et al. The comparative safety of rosuvastatin: a retrospective matched cohort study in over 48,000 initiators of statin therapy. Pharmacoepidemiol Drug Saf 2006; 15:444.
Guthrie RM, Martin DR. The safety of rosuvastatin: effects on renal and hepatic function. Expert Opin Drug Saf 2007; 6:573.
García-Rodríguez LA, Massó-González EL, Wallander MA, Johansson S. The safety of rosuvastatin in comparison with other statins in over 100,000 statin users in UK primary care. Pharmacoepidemiol Drug Saf 2008; 17:943.
García-Rodríguez LA, González-Pérez A, Stang MR, et al. The safety of rosuvastatin in comparison with other statins in over 25,000 statin users in the Saskatchewan Health Databases. Pharmacoepidemiol Drug Saf 2008; 17:953.
Dormuth CR, Hemmelgarn BR, Paterson JM, et al. Use of high potency statins and rates of admission for acute kidney injury: multicenter, retrospective observational analysis of administrative databases. BMJ 2013; 346:f880.
Bangalore S, Fayyad R, Hovingh GK, et al. Statin and the risk of renal-related serious adverse events: Analysis from the IDEAL, TNT, CARDS, ASPEN, SPARCL, and other placebo-controlled trials. Am J Cardiol 2014; 113:2018.
Yang CC, Jick SS, Jick H. Lipid-lowering drugs and the risk of depression and suicidal behavior. Arch Intern Med 2003; 163:1926.
Golomb BA, Kane T, Dimsdale JE. Severe irritability associated with statin cholesterol-lowering drugs. QJM 2004; 97:229.
Redelmeier DA, Thiruchelvam D, Daneman N. Delirium after elective surgery among elderly patients taking statins. CMAJ 2008; 179:645.
Marcantonio ER. Statins and postoperative delirium. CMAJ 2008; 179:627.
CGS News www.cbsnews.com/stories/2004/05/24/eveningnews/main619351.shtml (Accessed on March 07, 2005).
Graveline D. Lipitor: Thief of memory: Statin Drugs and the Misguided War on Cholesterol, Infinity Publishing, Haverford, PA 2004.
Wagstaff LR, Mitton MW, Arvik BM, Doraiswamy PM. Statin-associated memory loss: analysis of 60 case reports and review of the literature. Pharmacotherapy 2003; 23:871.
Muldoon MF, Barger SD, Ryan CM, et al. Effects of lovastatin on cognitive function and psychological well-being. Am J Med 2000; 108:538.
Muldoon MF, Ryan CM, Sereika SM, et al. Randomized trial of the effects of simvastatin on cognitive functioning in hypercholesterolemic adults. Am J Med 2004; 117:823.
Richardson K, Schoen M, French B, et al. Statins and cognitive function: a systematic review. Ann Intern Med 2013; 159:688.
Ott BR, Daiello LA, Dahabreh IJ, et al. Do statins impair cognition? A systematic review and meta-analysis of randomized controlled trials. J Gen Intern Med 2015; 30:348.
Strom BL, Schinnar R, Karlawish J, et al. Statin Therapy and Risk of Acute Memory Impairment. JAMA Intern Med 2015; 175:1399.
Rojas-Fernandez CH, Cameron JC. Is statin-associated cognitive impairment clinically relevant? A narrative review and clinical recommendations. Ann Pharmacother 2012; 46:549.
Newman TB, Hulley SB. Carcinogenicity of lipid-lowering drugs. JAMA 1996; 275:55.
Baigent C, Keech A, Kearney PM, et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet 2005; 366:1267.
Dale KM, Coleman CI, Henyan NN, et al. Statins and cancer risk: a meta-analysis. JAMA 2006; 295:74.
Browning DR, Martin RM. Statins and risk of cancer: a systematic review and metaanalysis. Int J Cancer 2007; 120:833.
Strandberg TE, Pyörälä K, Cook TJ, et al. Mortality and incidence of cancer during 10-year follow-up of the Scandinavian Simvastatin Survival Study (4S). Lancet 2004; 364:771.
Ford I, Murray H, Packard CJ, et al. Long-term follow-up of the West of Scotland Coronary Prevention Study. N Engl J Med 2007; 357:1477.
Heart Protection Study Collaborative Group, Bulbulia R, Bowman L, et al. Effects on 11-year mortality and morbidity of lowering LDL cholesterol with simvastatin for about 5 years in 20,536 high-risk individuals: a randomised controlled trial. Lancet 2011; 378:2013.
Yu Y, Ohmori K, Chen Y, et al. Effects of pravastatin on progression of glucose intolerance and cardiovascular remodeling in a type II diabetes model. J Am Coll Cardiol 2004; 44:904.
Wong V, Stavar L, Szeto L, et al. Atorvastatin induces insulin sensitization in Zucker lean and fatty rats. Atherosclerosis 2006; 184:348.
Chen Y, Ohmori K, Mizukawa M, et al. Differential impact of atorvastatin vs pravastatin on progressive insulin resistance and left ventricular diastolic dysfunction in a rat model of type II diabetes. Circ J 2007; 71:144.
Mita T, Watada H, Nakayama S, et al. Preferable effect of pravastatin compared to atorvastatin on beta cell function in Japanese early-state type 2 diabetes with hypercholesterolemia. Endocr J 2007; 54:441.
Yamakawa T, Takano T, Tanaka S, et al. Influence of pitavastatin on glucose tolerance in patients with type 2 diabetes mellitus. J Atheroscler Thromb 2008; 15:269.
Sathyapalan T, Kilpatrick ES, Coady AM, Atkin SL. The effect of atorvastatin in patients with polycystic ovary syndrome: a randomized double-blind placebo-controlled study. J Clin Endocrinol Metab 2009; 94:103.
Freeman DJ, Norrie J, Sattar N, et al. Pravastatin and the development of diabetes mellitus: evidence for a protective treatment effect in the West of Scotland Coronary Prevention Study. Circulation 2001; 103:357.
Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008; 359:2195.
Shepherd J. Glasgow Royal Infirmary, 2008, personal communication.
Coleman CI, Reinhart K, Kluger J, White CM. The effect of statins on the development of new-onset type 2 diabetes: a meta-analysis of randomized controlled trials. Curr Med Res Opin 2008; 24:1359.
Sattar N, Preiss D, Murray HM, et al. Statins and risk of incident diabetes: a collaborative meta-analysis of randomised statin trials. Lancet 2010; 375:735.
Preiss D, Seshasai SR, Welsh P, et al. Risk of incident diabetes with intensive-dose compared with moderate-dose statin therapy: a meta-analysis. JAMA 2011; 305:2556.
Carter AA, Gomes T, Camacho X, et al. Risk of incident diabetes among patients treated with statins: population based study. BMJ 2013; 346:f2610.
Swerdlow DI, Preiss D, Kuchenbaecker KB, et al. HMG-coenzyme A reductase inhibition, type 2 diabetes, and bodyweight: evidence from genetic analysis and randomised trials. Lancet 2015; 385:351.
Frayling TM. Statins and type 2 diabetes: genetic studies on target. Lancet 2015; 385:310.
Ridker PM, Pradhan A, MacFadyen JG, et al. Cardiovascular benefits and diabetes risks of statin therapy in primary prevention: an analysis from the JUPITER trial. Lancet 2012; 380:565.
Wang KL, Liu CJ, Chao TF, et al. Statins, risk of diabetes, and implications on outcomes in the general population. J Am Coll Cardiol 2012; 60:1231.
Gerson RJ, MacDonald JS, Alberts AW, et al. On the etiology of subcapsular lenticular opacities produced in dogs receiving HMG-CoA reductase inhibitors. Exp Eye Res 1990; 50:65.
Schlienger RG, Haefeli WE, Jick H, Meier CR. Risk of cataract in patients treated with statins. Arch Intern Med 2001; 161:2021.
Smeeth L, Hubbard R, Fletcher AE. Cataract and the use of statins: a case-control study. QJM 2003; 96:337.
Klein BE, Klein R, Lee KE, Grady LM. Statin use and incident nuclear cataract. JAMA 2006; 295:2752.
Harris ML, Bron AJ, Brown NA, et al. Absence of effect of simvastatin on the progression of lens opacities in a randomised placebo controlled study. Oxford Cholesterol Study Group. Br J Ophthalmol 1995; 79:996.
Leuschen J, Mortensen EM, Frei CR, et al. Association of statin use with cataracts: a propensity score-matched analysis. JAMA Ophthalmol 2013; 131:1427.
Bang CN, Greve AM, La Cour M, et al. Effect of Randomized Lipid Lowering With Simvastatin and Ezetimibe on Cataract Development (from the Simvastatin and Ezetimibe in Aortic Stenosis Study). Am J Cardiol 2015; 116:1840.
Gaist D, Jeppesen U, Andersen M, et al. Statins and risk of polyneuropathy: a case-control study. Neurology 2002; 58:1333.
Anderson JL, Muhlestein JB, Bair TL, et al. Do statins increase the risk of idiopathic polyneuropathy? Am J Cardiol 2005; 95:1097.
Dobs AS, Schrott H, Davidson MH, et al. Effects of high-dose simvastatin on adrenal and gonadal steroidogenesis in men with hypercholesterolemia. Metabolism 2000; 49:1234.
Davidson MH, Stein EA, Dujovne CA, et al. The efficacy and six-week tolerability of simvastatin 80 and 160 mg/day. Am J Cardiol 1997; 79:38.
Azzarito C, Boiardi L, Vergoni W, et al. Testicular function in hypercholesterolemic male patients during prolonged simvastatin treatment. Horm Metab Res 1996; 28:193.
Santini SA, Carrozza C, Lulli P, et al. Atorvastatin treatment does not affect gonadal and adrenal hormones in type 2 diabetes patients with mild to moderate hypercholesterolemia. J Atheroscler Thromb 2003; 10:160.
Hosokawa A, Bar-Oz B, Ito S. Use of lipid-lowering agents (statins) during pregnancy. Can Fam Physician 2003; 49:747.
Edison RJ, Muenke M. Central nervous system and limb anomalies in case reports of first-trimester statin exposure. N Engl J Med 2004; 350:1579.
Bateman BT, Hernandez-Diaz S, Fischer MA, et al. Statins and congenital malformations: cohort study. BMJ 2015; 350:h1035.
Kazmin A, Garcia-Bournissen F, Koren G. Risks of statin use during pregnancy: a systematic review. J Obstet Gynaecol Can 2007; 29:906.
Taguchi N, Rubin ET, Hosokawa A, et al. Prenatal exposure to HMG-CoA reductase inhibitors: effects on fetal and neonatal outcomes. Reprod Toxicol 2008; 26:175.
Costantine MM, Cleary K, Eunice Kennedy Shriver National Institute of Child Health and Human Development Obstetric–Fetal Pharmacology Research Units Network. Pravastatin for the prevention of preeclampsia in high-risk pregnant women. Obstet Gynecol 2013; 121:349.
Miettinen TA. Diurnal variation of cholesterol precursors squalene and methyl sterols in human plasma lipoproteins. J Lipid Res 1982; 23:466.
Saito Y, Yoshida S, Nakaya N, et al. Comparison between morning and evening doses of simvastatin in hyperlipidemic subjects. A double-blind comparative study. Arterioscler Thromb 1991; 11:816.
Wallace A, Chinn D, Rubin G. Taking simvastatin in the morning compared with in the evening: randomised controlled trial. BMJ 2003; 327:788.
Cilla DD Jr, Gibson DM, Whitfield LR, Sedman AJ. Pharmacodynamic effects and pharmacokinetics of atorvastatin after administration to normocholesterolemic subjects in the morning and evening. J Clin Pharmacol 1996; 36:604.
Rindone JP, Hiller D, Arriola G. A comparison of fluvastatin 40 mg every other day versus 20 mg every day in patients with hypercholesterolemia. Pharmacotherapy 1998; 18:836.
Matalka MS, Ravnan MC, Deedwania PC. Is alternate daily dose of atorvastatin effective in treating patients with hyperlipidemia? The Alternate Day Versus Daily Dosing of Atorvastatin Study (ADDAS). Am Heart J 2002; 144:674.
Jafari M, Ebrahimi R, Ahmadi-Kashani M, et al. Efficacy of alternate-day dosing versus daily dosing of atorvastatin. J Cardiovasc Pharmacol Ther 2003; 8:123.
Ferrer-García JC, Pérez-Silvestre J, Martínez-Mir I, Herrera-Ballester A. Alternate-day dosing of atorvastatin: effects in treating type 2 diabetic patients with dyslipidaemia. Acta Diabetol 2006; 43:75.
Wongwiwatthananukit S, Sansanayudh N, Dhummauppakorn R, Kitiyadisai C. Efficacy and safety of rosuvastatin every other day compared with once daily in patients with hypercholesterolemia. Ann Pharmacother 2006; 40:1917.
Backes JM, Venero CV, Gibson CA, et al. Effectiveness and tolerability of every-other-day rosuvastatin dosing in patients with prior statin intolerance. Ann Pharmacother 2008; 42:341.
Kayikçioğlu M, Ozerkan F, Soydan I. Effectiveness and safety of alternate-day simvastatin and fenofibrate on mixed hyperlipidemia. Am J Cardiol 1999; 83:1135.
Ruisinger JF, Backes JM, Gibson CA, Moriarty PM. Once-a-week rosuvastatin (2.5 to 20 mg) in patients with a previous statin intolerance. Am J Cardiol 2009; 103:393.
Drugs for lipids. Treat Guidel Med Lett 2008; 6:9.
www.fda.gov/Safety/MedWatch/SafetyInformation/ucm200635.htm (Accessed on February 19, 2010).
Chong PH, Seeger JD, Franklin C. Clinically relevant differences between the statins: implications for therapeutic selection. Am J Med 2001; 111:390.
Kasiske BL, Wanner C, O’Neill WC, National Lipid Association Statin Safety Task Force Kidney Expert Panel. An assessment of statin safety by nephrologists. Am J Cardiol 2006; 97:82C.
Tonelli M, Moyé L, Sacks FM, et al. Pravastatin for secondary prevention of cardiovascular events in persons with mild chronic renal insufficiency. Ann Intern Med 2003; 138:98.
Chalasani N, Aljadhey H, Kesterson J, et al. Patients with elevated liver enzymes are not at higher risk for statin hepatotoxicity. Gastroenterology 2004; 126:1287.
Khorashadi S, Hasson NK, Cheung RC. Incidence of statin hepatotoxicity in patients with hepatitis C. Clin Gastroenterol Hepatol 2006; 4:902.
Lewis JH, Mortensen ME, Zweig S, et al. Efficacy and safety of high-dose pravastatin in hypercholesterolemic patients with well-compensated chronic liver disease: Results of a prospective, randomized, double-blind, placebo-controlled, multicenter trial. Hepatology 2007; 46:1453.
Athyros VG, Tziomalos K, Gossios TD, et al. Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation (GREACE) Study: a post-hoc analysis. Lancet 2010; 376:1916.
Stojakovic T, Putz-Bankuti C, Fauler G, et al. Atorvastatin in patients with primary biliary cirrhosis and incomplete biochemical response to ursodeoxycholic acid. Hepatology 2007; 46:776.
Sorokin A, Brown JL, Thompson PD. Primary biliary cirrhosis, hyperlipidemia, and atherosclerotic risk: a systematic review. Atherosclerosis 2007; 194:293.
Abu Rajab M, Kaplan MM. Statins in primary biliary cirrhosis: are they safe? Dig Dis Sci 2010; 55:2086.
Copertina da https://cardiologydoc.wordpress.com/2012/05/27/understanding-the-cholesterol-skeptic/








