IL PROBLEMA
Il tumore della prostata è la neoplasia non-cutanea più diagnosticata negli Stati Uniti; con 233.000 diagnosi anno è la seconda causa di morte cancro-correlata tra gli uomini in US. Fino ad ora la diagnosi precoce è sembrata essere la strategia ottimale per migliorare il tasso di mortalità dato che i tumori localizzati sono curabili in modo ottimale con terapia focale-mirata al contrario di quelli metastatici che invece hanno una sopravvivenza piuttosto bassa, del 20-25% a 5 anni.
Il Psa
L’antigene specifico prostatico è stato approvato nel 1994 per fare screening su uomini asintomatici con tumore della prostata. Assieme all’esplorazione rettale il PSA ha incrementato di molto le possibilità di rilevare tumori prostatici. Nelle ultime 2 decadi la mortalità da questa patologia si è ridotta del 40% ed alcuni esperti ritengono che questo sia in buona parte merito dell’introduzione del PSA come test di screening di popolazione. Ma sarà davvero così? Vediamolo assieme
GLI STUDI
1
”L’European Randomized Study of Screening for Prostate Cancer (ERSPC)” ha randomizzato 182.000 uomini di età compresa tra 50 e 74 anni provenienti da 8 paesi europei confrontando i pazienti sottoposti a screening con quelli non sopposti a screening. Come endpoint primario è stata usata la mortalità. Lo screening con PSA è stato quindi eseguito ad un intervallo di 2-4 anni.
I Risultati
Dopo 13 anni di follow up, il “rate ratio” per l’incidenza di cancro prostatico tra i pazienti sottoposti a screening è stato di 1,57 (95% CI, 1.51-1.62) e quello per la mortalità di 0,79 (95% CI, 0.69-0.91) indicando un vantaggio nella capacità di identificare il tumore ed una ridotta mortalità. Il Number Needed to Screen per prevenire 1 morte da tumore della prostata è risultato di 781 (95% CI, 490-1929), questo significa che sono necessari 781 test del PSA per prevenire un unico decesso da cancro prostatico; mentre il numero di diagnosi da effettuare per prevenire un decesso è risultato di 27 (95% CI, 17-66).
2
Il “Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial” ha eseguito uno studio randomizzato su 76.000 uomini di età compresa tra 55 e 74 anni. La popolazione è stata anche in questo caso suddivisa in 2 gruppi: soggetti sottoposti a screening con PSA e soggetti non sottoposti al test.
I Risultati
Dopo 13 anni di follow up, il “rate ratio” per l’incidenza di tumore della prostata tra soggetti sottoposti a screening è stato dell’1,12 (95% CI, 1.07-1.17) mentre per la mortalità dell’1,09 (95% CI, 0.87-1.36) suggerendo da una parte un lieve vantaggio nella capacità di rilevare il tumore ma dall’altro un piccolissimo e paradossale svantaggio di sopravvivenza nei soggetti sottoposti a screeening con PSA. Dallo studio risulta quindi assenza di reale beneficio dall’utilizzo del test.
VANTAGGI E SVANTAGGI
Gli studi sopra riportati risultano emblematici del grande dibattito che caratterizza l’utilizzo del PSA come test di screening. Da questi studi sono state tratte alcune conclusioni, categorizzate in “vantaggi” e “svantaggi”:
Vantaggi
- Il beneficio primario dell’utilizzo del PSA include un 30% di rischio ridotto di sviluppare metastasi ed un 21% di riduzione della mortalità cancro correlata.
Svantaggi
- Tra gli svantaggi si ricorda come 1 uomo su 5 che si sottopone a screening risulta avere un PSA fuori range di normalità.
- Tra gli uomini sottoposti a biopsia prostatica per riscontro di PSA elevato il 75% non hanno una diagnosi di cancro
- Il tasso di falsi positivi appare molto alto
- Nella restante parte in cui invece si pone diagnosi di tumore il 50-75% ha una malattia a basso grado (Gleason < 6)
- Le biopsie sono manovre invasive e potenzialmente associate a dolore, ansia ed infezione (5% dei casi)
- Il trattamento di tutti i tumori della prostata presuppone una certa quota di sintomi e disturbi urinari, sessuali ed intestinali
- Lo screening per il tumore prostatico ha generato un grande incremento per la spesa sanitaria
CONCLUSIONI
Il PSA ha delimitato un’area di vivo dibattito in tutta la letteratura medica. Chi si definisce contrario all’uso di questo mezzo di screening argomenta sostenendo che i rischi e gli svantaggi legati alla tecnica superano di molti i benefici. Chi invece si definisce a favore sostiene come lo screening sia stato in gran parte responsabile del 45-70% della riduzione della mortalità cancro correlata riscontrata nelle ultime due decadi.
Sono quindi state analizzate due principali linee guida:
1
AUA (American Urology Association )
2
USPSTF (U.S. Preventive Services Task Force ).
La bontà di queste linee guida è stata valutata secondo JAMA sulla basi di alcuni parametri come indicati nella tabella che segue:
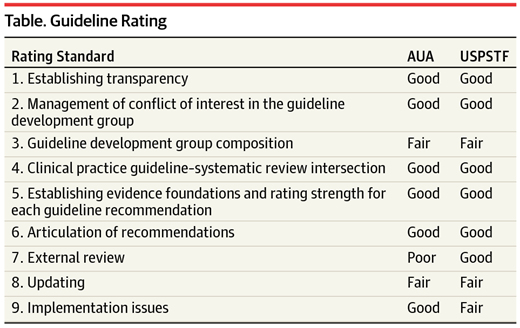
Sebbene le raccomandazioni delle linee guida sopra citate non siano sovrapponibili, entrambe concordano nel fatto che lo screening per il tumore della prostata debba essere pesantemente modificato.
In cosa concordano le linee guida?
C’è uniformità nel consenso riguardo ad alcuni punti:
- l’esecuzione del PSA “a tappeto” su tutta la popolazione senza un pretesto clinico dovrebbe essere abbandonato
- lo screening negli uomini con età superiore a 70 anni dovrebbe essere rivisto ed utilizzato solo in rari casi
- una prospettiva di vita inferiore a 10-15 anni dovrebbe precludere lo screening
- un valore di PSA elevato dovrebbe prevedere la ripetizione del test e la diagnosi di cancro prostatico non dovrebbe significare automaticamente “trattamento” (visto il recente fenomeno di overdiagnosis di questi anni che ha portato al trattamento di tumori che non avrebbero mai causato problemi di salute)
In cosa differiscono le linee guida?
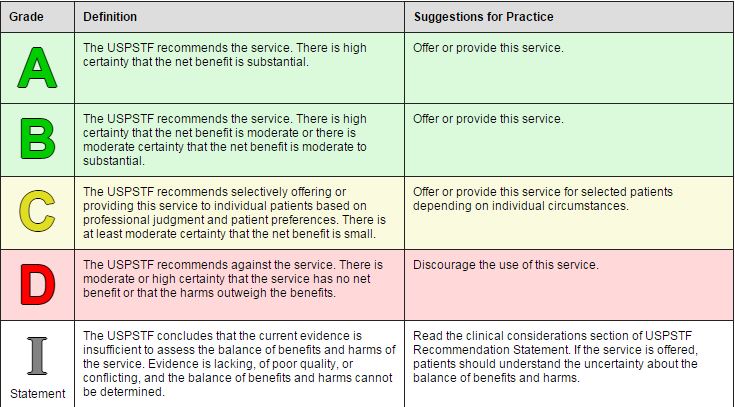
L’USPSTF scoraggia l’uso del PSA come test di screening

Dove il grado “D” sta per:
In contrasto è invece l’AUA che raccomanda uno screening limitato solo ad alcune fasce di età.
Si sconsiglia quindi:
– in assoluto l’uso del PSA in uomini più giovani di 40 anni (Forza di evidenza C)
– l’uso routinario in soggetti di età compresa tra 40 e 54 anni a rischio moderato (Forza di evidenza C)
– l’uso routinario in uomini con età uguale o superiore a 70 anni o con aspettativa di vita inferiore a 10-15 anni (Forza di evidenza C)
Per i soggetti di età compresa tra 55 e 69 anni è invece consigliata l’analisi dei singoli casi in base al rischio individuale ed alle preferenze del paziente stesso (Forza di evidenza B)
NB:Per i pazienti candidati allo screening, l’intervallo del test dovrebbe essere di 2 anni o superiore(Forza di evidenza C)
IN SINTESI
Da queste evidenze se ne deduce come il ruolo del PSA debba essere riconsiderato abbandonando la definzione di “test di screening” a favore della definizione più appropriata di “test di diagnosi su sospetto clinico individuale”
CURIOSITA’
Nuove Prospettive
Tra i nuovi approcci in sviluppo si ricordano:
- PCA3 (RNA-based urine test): è un gene che esprime un RNA non codificante. Il PCA3 è espresso solo nel tessuto prostatico umano ed il gene è altamente iperespresso nel tumore della prostata.
- prostate health index: misura i livelli di pro-PSA integrandoli tramite algoritmi con il PSA totale e con il PSA libero.
- 4k score (serum test) : un test che combina un pannello con 4 callicreine prostate-specifiche in un algoritmo in grado di individuare la percentuale di rischio individuale di avere un tumore della prostata aggressivo prima dell’esecuzione della biopsia.
- risonanza magnetica multiparametrica.
- Minimizzazione dell’overtreatment tramite:
1) l’utilizzo della sorveglianza attiva della gran parte del tumori low-grade e di alcuni intermediate-grade
2) l’utilizzo del profilo genomico sulla biopsia e il trattamento ablativo del tumore (focal therapy).
AUTORE
Daniele Angioni
BIBLIOGRAFIA:
Journal of America Medical Association, August 25, 2015: Prostate cancer screening Scott E.
Articolo al Link : http://jama.jamanetwork.com/article.aspx?articleid=2429697&resultClick=3American Cancer Society (February 2014)American College of
Physicians (May 2013)European Association of Urology ( January 2014)
National Comprehensive Cancer Network (January 2014)
Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014;64(1):9-29.
Efstathiou JA, Chen MH, Catalona WJ, et al. Prostate-specific antigen-based serial screening may decrease prostate cancer-specific mortality. Urology. 2006;68(2):342-347.
Moyer VA; US Preventive Services Task Force. Screening for prostate cancer: US Preventive Services Task Force recommendation statement. Ann Intern Med. 2012;157(2):120-134.
Carter HB, Albertsen PC, Barry MJ, et al. Early detection of prostate cancer: AUA guideline. J Urol. 2013;190(2):419-426.
Ilic D, O’Connor D, Green S, Wilt TJ. Screening for prostate cancer: an updated Cochrane systematic review. BJU Int. 2011;107(6):882-891.
Schröder FH, Hugosson J, Roobol MJ, et al. Screening and prostate cancer mortality: results of the ERSPC at 13 years of follow-up. Lancet. 2014;384(9959):2027-2035.
Roobol MJ, Kerkhof M, Schröder FH, et al. Prostate cancer mortality reduction by prostate-specific antigen-based screening adjusted for nonattendance and contamination in the ERSPC. Eur Urol. 2009;56(4):584-591.
Andriole GL, Crawford ED, Grubb RL III, et al. Prostate cancer screening in the randomized Prostate, Lung, Colorectal, and Ovarian Cancer Screening Trial. J Natl Cancer Inst. 2012;104(2):125-132.
Loeb S, Carter HB, Berndt SI, et al. Complications after prostate biopsy: data from SEER-Medicare. J Urol. 2011;186(5):1830-1834.
Etzioni R, Tsodikov A, Mariotto A, et al. Quantifying the role of PSA screening in the US prostate cancer mortality decline. Cancer Causes Control. 2008;19(2):175-181.
IMMAGINE DI COPERTINA








